Journal Club
Kurosh Parsi, Lois Zhang, Mark S Whiteley, Selene Vuong, Mina Kang, Nikita Naidu, Joseph Grace, David E Connor
Phlebology. 2024 Mar;39(2):80-95
doi: 10.1177/02683555231211086 Epub 2023 Oct 30.
Die aktuelle europäische sowie amerikanische Leitlinie zur Behandlung der Varikose empfehlen die endovenöse Ablation (thermisch oder nicht thermisch) der Stammvenen als 1. Wahl gegenüber der Crossektomie und Stripping-Operation zu bevorzugen.
Der Cyanoacrylat-Klebeverschluss ist ein relativ neues Verfahren, das als „sicher und effektiv“ zur Behandlung der Stammveneninsuffizienz dargestellt wird. Die Verschlussraten vom Cyanoacrylat-Klebeverschluss liegen in einer ähnlichen Größenordnung wie nach den endovenös thermischen Ablationsverfahren. Neben der Effektivität eines Verfahrens ist aber auch die Sicherheit von besonderer Bedeutung.
Ziel dieser Publikation aus der Arbeitsgruppe von Prof. K. Parsi in Australien ist, die bei den Behörden gemeldeten Nebenwirkungen nach der Anwendung von Cyanoacrylat-Klebeverschlüssen zu erfassen und zu analysieren.
Das erste zugelassene Produkt dieser Art war VenaSealTM (2011 Zulassung in der EU, 2012 in Australien, 2015 in den USA). Weitere ähnliche Produkte sind z.B. Vena-BlockTM, VeinOffTM, VariCloseTM, VenexTM.
Methoden:
Alle o.g. Produkten wurden in der Studie untersucht. Zur Auswertung wurden die Total Product Life Cycle (TPLC) Datenbank der US-amerikanischen Food and Drug Administration (FDA), die Database of Adverse Event Notifications (DAEN) der australischen Therapeutic Goods Administration (TGA) und die Yellow Card Datenbank der britischen Medicines and Healthcare Products Regulatory Agency (MHRA) hinzugezogen.
Des Weiteren fand eine umfangreiche Literaturrecherche bzgl. „Cyanoacrylat-Klebeverschluss, venöser Erkrankung und Therapie-Komplikationen“ statt.
Ergebnisse:
Nach der Anwendung von Cyanoacrylat -Klebern sind laut der Publikation von Parsi et al. in der TPLC-Datenbank der FDA 13 Todesfälle, 7 Schlaganfälle, 211 thromboembolische Ereignisse und 482 Immunreaktionen erfasst worden. Vergleichbare Publikationen zu den anderen endovenösen Techniken liegen nicht vor.
Schlussforderung:
Bei der bisherigen Literatur und bisherigen publizierten Studien (viele von Herstellern gesponsert) gelten schwerwiegende Komplikationen als selten und sind suboptimal erfasst. Nach der vorliegenden Publikation sollte die Sicherheit der Therapie zumindest kritisch hinterfragt werden.
Verfasserin
Dr. med. Stefania Gerontopoulou
Tabea Krankenhaus GmbH
Zentrum für Venen- und Dermatochirurgie
Kösterbergstraße 32
22587 Hamburg
Joel L. Cohen, MD,*† Jessica Hicks, PhD,‡ Alessandra Nogueira, MD,‡ Vanessa Lane, PhD,§ and Bill Andriopoulos, PhDk
DERMATOLOGIC SURGERY • February 2022 • Volume 48 • Number 2; 220-224
Die Datenlage zu Nebenwirkungen von FDA zugelassenen Fillerpräparaten ist dünn. Die Nebenwirkungen nach Behandlungen werden in early onset < 14 Tage und delayed onset >14 Tage Nebenwirkungen unterteilt. Early onset Nebenwirkungen gelten als Technik assoziiert und waren nicht relevant für diese Untersuchungen. Zu den late onset Nebenwirkungen zählen Knotenbildungen, Hypersensitivitätsreaktionen und Granulome.
Zwischen Januar 2016 und Januar 2021 wurden die postmarketing surveillance (PMS) Daten für die folgenden Filler in der Manufacturer and User Facility Device Experience (MAUDE) FDA Database erhoben: Juvederm Volbella (HAVOB; Allergan plc), Restylane Refyne (HAREF; Galderma SA), und Restylane Defyne (HADEF; Galderma SA), alle zugelassen 2016; Juvederm Vollure (HAVLR; Allergan plc), Teosyal RHA2/3/4 (HARH2/3/4; Teoxane SA), and Revanesse Versa (HAVER; Prollenium Medical Tech- nologies), and Restylane Kysse (HA ). Revanesse Versa (HA ver) wurde erst 2017 zugelassen und Restylane Kysse 2020. RHa 2/3/4 waren erst ab Mitte 20220 auf dem amerikanischen Markt verfügbar.
Die MAUDE Datenbank greift auf Firmendaten zurück sowie auf freiwillige Meldungen von Ärzten. Die Meldungen sind nicht standardisiert. Die Autoren berücksichtigen Einträge, welche sich auf Hypersensitivitätsreaktionen, entzündliche und nicht entzündliche Knoten und Granulome bezogen. Unter 585 Berichten, waren 195 (33,3%) delayed onset Nebenwirkungen zu verzeichnen: 71.8% waren Knoten (42.1% entzündliche and 29.7% nichtentzündliche), Hypersensitivitätreaktionen (21.5%), and Granulome (6.7%). Die Arbeit schlüsselt die Nebenwirkungen nach Fillergruppen auf. Die Relevanz dieser Aufschlüsselung ist fraglich, da einige der Präparate zum Untersuchung Zeitraum nicht auf dem US Markt verfügbar waren.
Entzündliche und nicht entzündliche Knoten stellen die häufigste delayed onset Nebenwirkung von Fillerbehandlungen dar. Die in der Literatur geschätzte Inzidenz von delayed onset Knoten liegt zwischen 0,02 und 4%. Laut Daten der American Society of Plastic Surgery wurden in dem Zeitraum 2016 bis 2019 8 Millionen dermale Fillerbehandlungen durchgeführt. Eine höhere Zahl an Fillernebenwirkungen wäre somit, in der MAUDE Datenbank zu erwarten. Die Autoren gehen davon aus, dass die Dokumentation von Fillernebenwirkungen deutlich unterrepräsentiert ist. Aufgrund der geringen Datenlage können keine Schlüsse auf Häufigkeit und Filler Assoziation getroffen werden.
Verfasserin
Dr. Daniela Greiner-Krüger
Medicorium
Zentrum für Dermatologie und Ästhetik
Nassauer Str. 10
61440 Oberursel
www.medicorium.de
Tamana Alozai, Eline Huizing, Michiel A. Schreve, Michael C. Mooij, Clarissa J. van Vlijmen, Willem Wisselink, Çağdaş Ünlü. A systematic review and meta-analysis of treatment modalities for anterior accessory saphenous vein insufficiency, Phlebology 2022 Apr;37(3):165-179. doi:10.1177/02683555211060998
Die Vena saphena accessoria anterior (VSAA) ist in 41% der Bevölkerung vorhanden, verläuft oberflächig und lateral der Vena saphena magna (VSM) am Oberschenkel und mündet in der saphenofemoralen Junktion. Eine Insuffizienz der VSAA ist verantwortlich für ca. 10% aller Krankheitsbilder die mit einer Varikose assoziiert sind und verursacht einen Schweregradscore-Index ähnlich dem der VSM Insuffizienz, sowie ähnliche Beschwerden bei den betroffenen Patienten. Des Weiteren werden signifikant mehr oberflächige Beinvenenthrombosen bei einer isolierten Insuffizienz der VSAA im Vergleich zu einer Insuffizienz der VSM dokumentiert. Die Behandlung einer insuffizienten VSAA hat demzufolge eine große Bedeutung. Die Therapie der Varikose hat sich in den letzten Jahren, insbesondere nach dem Einzug der minimal invasiven endovenösen Verfahren, breit gefächert und entwickelt, wobei die Studienlage zur optimalen Behandlung einer VSAA-Insuffizienz weiterhin limitiert bleibt.
Diese systematische Literaturrecherche und Meta-Analyse befasst sich mit den vorhandenen Therapieoptionen für die Behandlung einer isolierten Insuffizienz der VSAA, u.a. die endovenöse Laser (EVLA)- oder Radiofrequenzablation (RFA), den Cyanoacrylatkleber, die Sklerotherapie und die chirurgische Therapie. Die Literaturrecherche erfolgte in MEDLINE, Embase und Cochrane Library. Untersucht wurden Studien, die die Ergebnisse der Behandlung einer primären Insuffizienz der VSAA präsentierten, in Englisch abgefasst und als Volltext verfügbar waren. Primärer Endpunkt war der anatomische Verschlusserfolg, definiert als erfolgreiche Okklusion der Vene ohne Flusszeichen. Sekundäre Endpunkte waren Schmerzen während und nach der Therapie, der Schweregrad der Erkrankung, gemessen mit dem „Venous clinical severity score“ (VCSS), die Lebensqualität, die Patientenzufriedenheit, das ästhetische Ergebnis, Komplikationen (tiefe und oberflächige Beinvenenthrombose, Verbrennungen, Parästhesien, Hyperpigmentierungen) und die Zeit der Wiederaufnahme von täglichen Aktivitäten. Die methodische Qualität der Studien wurde anhand des „Methodological Index for Non-Randomized Studies (MINORS)“ Score bewertet.
Die Literaturrecherche konnte 861 Studien identifizieren, wovon nach dem ersten Screening 81 zum full-text review geeignet erschienen. In dieses systematische Review wurden anschließend 16 Studien, die die Einschlusskriterien erfüllten, eingeschlossen. Die meisten Studien waren retrospektiv und von geringer bis moderater Qualität, gemessen anhand des MINORS-Scores.
Insgesamt wurden 609 VSAA behandelt und dokumentiert. Die anatomische Erfolgsrate (erster Endpunkt) lag nach EVLA und RFA (11 Studien) bei 91,8%, nach Cyanoacrylatkleber bei 93.6% (3 Studien), 79,8% nach Sklerotherapie (2 Studien), 97,9% nach Phlebektomien und 82% nach CHIVA.
Parästhesien wurden bei 0,7% der Patienten nach EVLA (6 Studien) beobachtet. Eine OVT trat bei 2,6% der Patienten nach RFA auf (2 Studien), bei 27% nach Sklerotherapie (1 Studie) und bei 12% der Patienten nach Phlebektomien. Eine tiefe Beinvenenthrombose oder Verbrennungen der Haut wurden nicht dokumentiert. Vereinzelte Studien dokumentierten eine hohe Patientenzufriedenheit von 84% nach EVLA.
Zusammenfassend ist die Behandlung einer isolierten Insuffizienz der VSAA sicher und effektiv. Eine Behandlung mittels Phlebektomien liefert sehr gute Erfolgsraten bei intakter saphenofemoraler Junktion. Weniger erfolgreiche Ergebnisse wurden nach CHIVA und Sklerotherapie gesehen.
Verfasserin
Dr. med. Stefania Gerontopoulou
Tabea Krankenhaus GmbH
Zentrum für Venen- und Dermatochirurgie
Kösterbergstraße 32
22587 Hamburg
Fedor Lurie, Marc Passman, Mark Meisner, Michael Dalsing, Elna Masuda et al. February 2020 Journal of Vascular Surgery Venous and Lymphatic Disorders 8(3) DOI:10.1016/j.jvsv.2019.12.075
https://angiolife.com.ua/media/pages/files/CEAP%202020.pdf
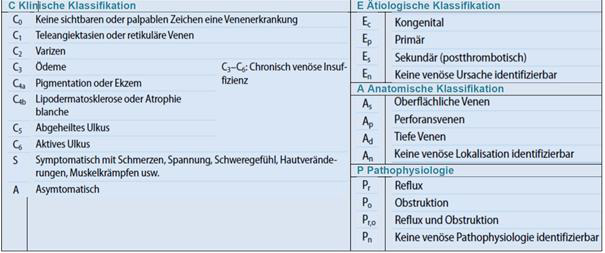
Die CEAP-Klassifikation ist das entscheidende Instrument zur Einteilung der chronisch venösen Insuffizienz und wissenschaftlichen Einordnung des Schweregrades eines Venenleidens. Sie ist weltweit anerkannt und mit einer guten Reproduzierbarkeit verbunden und deswegen wird sie im Rahmen klinischer Studien und im phlebologischen Alltag empfohlen und eingesetzt. Die CEAP-Klassifikation wurde 1994 von einem internationalen „Ad Hoc Committee des American Venous Forum“ eingeführt.
Im klinischen Alltag wird allerdings die revidierte einfache CEAP-Klassifikation von 2004 verwendet, welche die klinischen (C), ätiologischen (E), anatomischen (A) und pathophysiologischen (P) Aspekte des Venenleidens zusammenfasst:
Im Mai 2017 begann im Rahmen des „American Venous Forum“ eine erneute Revision, die in vier Phasen verlief und 2020 mit dem o.g. Artikel beendet wurde. Wichtige Punkte waren der Erhalt der guten Reproduzierbarkeit und praktischen Anwendung der CEAP-Klassifikation, die Kompatibilität mit der älteren Version und das evidenzbasierte Ergebnis. Wie sieht nun die neue CEAP-Klassifikation aus und welche relevanten Änderungen erwarten uns?
Zu den klinischen Aspekten (C):
- Die Rezidivvarikose wird berücksichtigt (C2r)
- Die Corona phlebectatica paraplantaris wird als neue Subkategorie integriert (C4c)
- Das Rezidiv eines floriden Ulcus erhält eine neue Subkategorie (C6r).
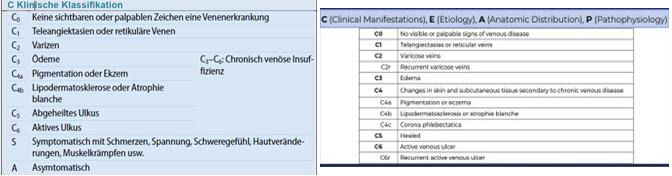
Zu den ätiologischen Aspekten (E):
Es gibt zwei Subkategorien der sekundären Varikose/CVI
- Esi: für intravasale Ursachen eines Wand- oder Klappendefekts, z.B. tiefe Beinvenenthrombose, traumatische arteriovenöse Fisteln, intravenöse Sarkome
- Ese: extravasale Ursachen, z.B. zentrale venöse Hypertonie aufgrund von Adipositas, Venenkompression aufgrund von Tumoren, motorische Dysfunktionen aufgrund von Paraplegie, Arthritis, oder chronische Immobilisation

| E class | Description |
|---|---|
| Ep | Primary |
| Esi | Secondary intravenous |
| Ese | Secondary extravenous |
| Ec | Congenital |
| En | No cause identified |
Zu den anatomischen Aspekten (A):
- Zahlenwerte, die ein bestimmtes Gefäß beschrieben haben wurden durch anatomische Abkürzungen ersetzt, z.B. “2.” für Insuffizienz der Vena-saphena-magna oberhalb des Knies wird neu als “GSVa” bezeichnet.
Zu den pathophysiologischen Aspekten (P):
- Die Aufteilung bleibt gleich und umfasst den pathologischen Befund, der den Reflux (r), die Obstruktion (o), beides (r,o) oder eine nicht detektierbare Pathophysiologie (n) benennt.
- Es wird empfohlen die neuen Abkürzungen (A) zusätzlich zu benutzen um die Lokalisation des pathologischen Befundes zu beschreiben.
Schlussfolgernd ist die CEAP-Klassifikation weiterhin ein sehr gutes Instrument für den phlebologischen Alltag, als auch für klinische Studien. Sie bleibt klinisch sehr praktikabel und unstrittig aussagekräftig. Die neuen revidierten Punkte bieten eine detailliertere Aussage zum bestehenden Venenleiden ohne die Praktikabilität des Instruments zu beeinflussen.
Verfasserin
Dr. med. Stefania Gerontopoulou
Tabea Krankenhaus GmbH
Zentrum für Venen- und Dermatochirurgie
Kösterbergstraße 32
22587 Hamburg
Konrad Haug 1, Helmut Breuninger 1, Gisela Metzler 2, Thomas Eigentler 1, Martin Eichner 3, Hans-Martin Häfner 1, Saskia M Schnabl 4
1 Department of Dermatology, University of Tübingen, Tübingen, Germany.
2 Centre for Dermatohistopathology and Oral and Maxillofacial Pathology Tübingen-Wuerzburg and Department of Dermatology, University of Tübingen, Tübingen, Germany.
3 Department of Clinical Epidemiology and Applied Biometry, University of Tübingen, Tübingen, Germany.
4 Department of Dermatology, University of Tübingen, Tübingen, Germany. Electronic address: saskia.schnabl@med.uni-tuebingen.de.
J Invest Dermatol 2020 Oct;140(10):1968-1975. doi: 10.1016/j.jid.2020.01.035. Epub 2020 Mar 10.
Ca. 95 % der kutanen Plattenepithelkarzinome können primär kurativ dermatochirurgisch versorgt werden. Nur in ca. 5 % kommt es zu Lokalrezidiven oder einer lokoregionären und ggf. Fernmetastasierung. Immer wieder werden Risikofaktoren für diese Tumorprogression in den unterschiedlichen Leitliniengremien weltweit diskutiert und teils unterschiedlich bewertet. Schwierigkeiten bereiten hierbei die aufgrund der geringen Patientenzahlen oftmals schlecht gepowerten Studien und häufig sehr unterschiedlich zusammengesetzten Patientenkollektive mit folglich unterschiedlich dargestelltem Lokalrezidiv- und Metastasierungsrisiko. In der S3-Leitlinie „Aktinische Keratose und Plattenepithelkarzinom der Haut“ (Fassung März 2020) sind folgende Risikofaktoren für ein erhöhtes Rezidiv- und/oder Metastasierungsrisiko zusammengefasst:
vertikale Tumordicke > 6 mm, horizontaler Tumordurchmesser > 20 mm, desmoplastisches Wachstum, perineurale Infiltration, Immunsuppression, Lokalisation Ohr/ Lippe, Entdifferenzierung (G3,G4).
Nach Übersicht der aktuellen internationalen Publikationslage wurden die vertikale Tumordicke > 6 mm und die Desmoplasie bislang als die wichtigsten prognostischen Faktoren eingeschätzt.
Die Autoren der Tübinger Hautklinik um Herrn Konrad Haug untersuchten in einer prospektiven monozentrischen Studie 1399 Patienten, die zwischen 2005 – 2015 an einem kutanem Plattenepithelkarzinom (squamous cell carcinoma, SCC) behandelt wurden. Litt ein Patient an mehreren SCC gleichzeitig, so wurde der Tumor mit dem höchsten Risikoprofil eingeschlossen. SCC mit einer Tumordicke ≥ 6 mm sowie SCC mit desmoplastischem Wachstum (dSCC) mit einer Tumordicke von 2.1 – 5.9 mm wurden zudem auf eine perineurale Invasion (PNI) untersucht. Das mediane Follow-up lag bei 36,5 Monaten. 67 % der Patienten waren männlich, das mediane Erkrankungsalter lag bei 78 Jahren (30.0 – 96.8). Insgesamt zeigten 145 Tumore ein desmoplastisches Wachtumsverhalten, 21 dieser Tumore entwickelten zudem eine PNI. Tumore mit Entwicklung einer PNI ohne Desmoplasie und dünnere SCC < 2 mm mit PNI wurden somit in dieser Studie nicht gesondert untersucht. Es zeigten sich bei allen untersuchten Untergruppen (non dSCC, dSCC, dSCC mit PNI) vorrangig gut differenzierte Tumore mit Grading 1-3. Beim Anteil der immunsupprimierten Patienten unterschieden sich die Subgruppen deutlich: bei der Gruppe der non dSCC waren 10 % der Patienten immunsupprimiert, bei den dSCC 26.9 % und bei den dSCC mit PNI 33.3 %. Zudem fällt auf, dass der durchschnittliche Tumordurchmesser sowohl in der Gruppe der dSCC (30.7 mm, p<0.0001) als auch der dSCC mit PNI (40.7 mm, p< 0.0001) signifikant größer war im Vergleich zu den nondSCC (21.7 mm). Diese statistisch signifikanten Unterschiede zeigten sich ebenfalls bei der durchschnittlichen Tumordicke: nondSCC waren im Schnitt 4.31 mm dick, dSCC 6.7 mm (p<0.0001) und dSCC mit PNI 8.8 mm (p< 0.0001). Auch in der Tumorprogression definiert als Lokalrezidiv oder Auftreten von Metastasen, im Outcome der Patienten und Tumorspezifischen Tod der jeweiligen Patientengruppen spiegelten sich diese Unterschiede wider:
sowohl die Tumorprogression gesamt (nondSCC 7,2 %; dSCC 35,2 %, p <0.0001; dSCC mit PNI 71.4 %, p < 0.0001) zeigte signifikant höhere Werte der dSCC und dSCC mit PNI im Vergleich zu den nicht desmoplastischen SCC als auch alle Unterformen der Progression einzeln (in transit/ Satellitenmetastasen, Lokalrezidiv, Lymphknotenmetastasierung, Fernmetastasierung, tumorspezifischer Tod). Dementsprechend schlechter zeigte sich auch das progressionsfreie Überleben nach 5 Jahren: waren es bei den nondSCC 89 %, so betrug das progression-free survival bei den dSCC nur noch 50 % und bei den dSCC mit PNI nur noch 17 %.
Zusammenfassend zeigt diese gut gepowerte Studie einen schönen Überblick über den Einfluss der Risikofaktoren auf Lokalrezidiv- und Metastasierungsrisiko beim SCC. Sie bestätigt alle Risikofaktoren, die bereits in der S3-Leitlinie dargestellten wurden, allerdings in einer etwas anderen Gewichtung: in einer multivariaten Analyse der Risikofaktoren war die Desmoplasie mit einer Hazard Ratio von 3,32 der schwerwiegendste Risikofaktor gefolgt von der Perineuralen Infiltation (HR 2,48) und der vertikalen Tumordicke ≥ 6 mm (HR 2,03). Insbesondere die Kombination mehrerer Risikofaktoren, die durch prozentual höhere Anzahl der Patienten mit Immunsuppression, durchschnittlich erhöhtem horizontalen Tumordurchmesser und durchschnittlich höherer vertikaler Tumordicke in der Subgruppe der Desmoplasie und der Subgruppe der Desmoplasie mit Perineuralem Wachstum durch die Kollegen dargestellt wurden, zeigt eindrücklich das deutlich schlechtere Outcome insbesondere beim Auftreten mehrerer Risikofaktoren gleichzeitig.
Insbesondere bei solchen high-risk-Tumoren ist aufgrund des deutlich erhöhten Lokalrezidiv- und Metastasierungsrisikos auch bei operativ erreichter R0-Resektion aus meiner Sicht ein adjuvantes Procedere zu diskutieren. Hier sind die adjuvanten Therapiekonzepte beim SCC allerdings aktuell überschaubar: so sollte eine adjuvante Radiatio laut aktueller S3-Leitlinie nur bei einem knappen Resektionsabstand (< 2 mm ohne Möglichkeit der Nachresektion), bei einer ausgedehnten Perineuralscheideninfiltration sowie nach erfolgter Resektion von Lymphknotenmetastasen durchgeführt werden. Andere der o.g. Risikofaktoren werden bislang nicht für die Einleitung einer adjuvanten Therapie berücksichtigt. Angesichts der vorliegenden Studiendaten sollte aus meiner Sicht im Individualfall insbesondere bei Kombination mehrerer high-risk-Faktoren im Rahmen von interdisziplinären Tumorkonferenzen festgelegt werden, welche adjuvanten Therapiekonzepte (Radiatio) dem jeweiligen Patienten angeboten werden können. Hierbei bleibt abzuwarten, welche Rolle der einzige bislang beim inoperablen nicht bestrahlbaren SCC zugelassene anti-PD1 Cemiplimab eventuell in der Rolle der Adjuvanz spielen wird. Aktuell wird in zwei Phase-II-Studien der adjuvante Einsatz von Cemiplimab dahingehend überprüft.
Verfasserin
Dr. med. Sonja Dengler
Oberärztin Hautklinik
Klinikum Dortmund gGmbH
Beurhausstraße 40
44137 Dortmund
Wie manch einem brillentragenden Operateur ist mir der Zustand z. T. feinster Blutstropfen auf den Gläsern wohl vertraut. Große Bedenken hinsichtlich eines Risikos durch Blutspritzer hatte ich bislang nicht.
Auf der Suche nach einer besonderen dermatochirurgischen Publikation des letzten Jahres für diesen Newsletter „spritzte“ mir eine Studie im BJD gewissermaßen ins Auge:
Aguilar-Duran S, Panthagani A, Naysmith L, Holme SA
British Journal of Dermatology (2017) 176, pp270–280
Im Rahmen von dermatochirurgischen Eingriffen wurde die Kontamination des Operateurs bzw. der OP-Assistenz durch Blutspritzer auf 33 bzw. 15% geschätzt. OP-Mundschutz mit Visier wurde daher häufiger angewendet, um OP-Personal vor einer mukokutanen Virusübertragung zu schützen.
Die Autoren berichten in einem Letter über eine Studie zur Schutzwirkung von Visier-Mundschutz:
Bei insgesamt 345 dermatochirurgischen Eingriffen in einem Zeitraum von drei Wochen wurde 410x Mundschutz mit Visier (355x Operateur, 57x Assistenz) überprüft. Mit einem sehr sensitiven Test konnte Hämoglobin in 62 Fällen (15,1%) am Mundschutz nachgewiesen werden (Operateur 14,4%, Assistent 19%), wobei in 84% Blut lediglich auf der Außenseite des Visiers detektiert wurde. Durchschnittlich wurden 7,6 Blutstropfen (1-30) auf der Visieraußenseite gezählt. Bei 5% war auf der Außenseite des Visiers nur mikroskopisch Blut nachweisbar, jedoch fand sich in 4 Fällen (6%) Blutspritzer bzw. Hämoglobin auf der Innenseite des Visiers.
In der univariaten Analyse waren die Dauer einer Operation und der Gebrauch einer bipolaren Pinzette signifikante Risikofaktoren für Blutspritzer am Mundschutz, während eine Antikoagulation des Patienten keine Rolle spielte. In der multivariaten Auswertung war der Gebrauch bipolarer Elektrokoagulation der bedeutendste Risikofaktor für Blutspritzer (Odds Ratio 12,52; 95%-KI 3,87-40,43; p<0,001).
Das Besondere an dieser Untersuchung ist, dass mit einem sensitiven Hämoglobintest auch eine geringe Kontamination detektiert wurde und dass sogar auf der Innenseite des Visiers eine wohl aerosolbedingte Blutkontamination nachgewiesen werden konnte.
Die Autoren forderten daher, nach jedem Eingriff, auch ohne sichtbare Blutspritzer, grundsätzlich den Mundschutz zu wechseln. Das zwar geringe Risiko nach einer mukokutanen Blutexposition sollte nicht ignoriert werden. Da lediglich der Nachweis von Hämoglobin als Hinweis für eine Kontamination herangezogen wurde und nicht die Exposition mit anderen virushaltigen Körperflüssigkeiten, wurde möglicherweise ein zusätzliches Risiko nicht berücksichtigt.
Die Ergebnisse der Untersuchung erscheinen sehr plausibel.
Die wichtigste Botschaft der Arbeit ist, gerade beim Gebrauch bipolarer Elekrokoagulation einen Mundschutz mit Visier zu tragen.
Verfasser
Prof. Dr. Matthias Möhrle
Praxisklink Tübingen - Haut und Venen
Lehrpraxis der Universität Tübingen für das Fachgebiet Dermatologie
Europaplatz 2
D-72072 Tübingen
Al-Haddab M1, Abduljabbar A1, Al-Somaily A. †
1Departments of Dermatology, and †Microbiology, King Saud University, Riyadh, Saudi Arabia.
Abstract
Background: Hyaluronsäure- (HS) Gel Filler stellen gegenwärtig die meisten Weichteil-augmentations-Verfahren dar, weil sie geringere Raten an Komplikationen im Vergleich zu anderen Materialien haben. Viele Patienten verbrauchen nicht eine ganze Spritze des Fillers, aber benötigen nach einiger Zeit eventuell eine Auffrischung (Retouch) oder intermittierende Behandlungen. Das restliche Material wird zur Folgenutzung am selben Patienten aufbewahrt.
Objective: Es gibt in der Literatur auf Grund eines Mangels an Studien nur eine ungenügende Anzahl an Empfehlungen bezüglich der Sicherheit einer Lagerung und der Folgenutzung des dermalen Fillers. Das Ziel dieser Studie besteht darin, eine mögliche infektiöse Verunreinigung in Verbindung mit der Lagerung von HS-Fillern nach der Patientenbehandlung zu untersuchen.
Methods: Hyaluronsäuren von vorher benutzten Spritzen wurden bei Raumtemperatur unter sterilen Bedingungen für unterschiedliche Zeiträume ab 2009 aufgehoben. Später wurden die Materialien kulturellen Untersuchungen unterzogen, einschließlich gram-positiver und gram-negativer Bakterien, Mykobakterien sowie Pilzen.
Results: Von keiner Probe wurden Pilze oder Mykobakterien kultiviert. Es zeigten sich einige positive bakterielle Kulturen, diese waren aber vorwiegend mit der normalen Hautoberflächenflora kontaminiert.
Conclusion: Obwohl im Allgemeinen praktiziert, trägt die Lagerung von HS-Fillern nach der initialen Injektion am Patienten ein reales aber geringes Risiko einer Kontamination.
Dermatol Surg 2017;0:1–4· DOI: 10.1097/DSS.0000000000001091
Kommentar
Die Autoren untersuchten das potenzielle Kontaminationsrisiko von Hyaluronsäure-Fillern, nachdem diese bereits angebrochen und teilweise am Patienten injiziert wurden. Sie markierten 36 benutzte Spritzen (Juvéderm® Ultra und Restylane®), setzten die Originalverschlüsse wieder auf und bewahrten diese in der Originalverpackung bei Raumtemperatur in einem Schrank über einen Zeitraum von durchschnittlich 57,8 Monaten (32,87-71,57 Monate) auf. Anschließend führten die Autoren mehrere in-vitro-Untersuchungen zum Ausschluss einer etwaigen Kontamination mit anaeroben und aeroben Bakterien, Mykobakterien und Pilze durch. Die Inhalte von 5 der 36 Spritzen waren mit Staphylococcus epidermidis, Corynebacterium species und Bacillus species kontaminiert. Die Autoren weisen darauf hin, dass das Risiko einer Kontamination in der angebrochenen Spritze zwar gering jedoch real ist, ohne sich daraus ergebende Infektionen im Gewebe abzuleiten. Die Aufbewahrung angebrochener Hyaluronsäure-Spritzen zur erneuten Injektion am gleichen Patienten ist nicht zuletzt aus kommerziellen Gründen eine zunehmende Angewohnheit vieler Ärzte. Da in der Literatur nur wenige und unvollständige Daten zum Thema Lagerung nach Anbruch eines HS-Fillers und einer damit möglich verbundenen Kontamination vorliegen1-4, trägt die aktuelle Arbeit dazu bei, wissenschaftliche Daten zur Sicherheit einer Lagerung zu erhalten. Positiv zu bewerten ist hierbei die sehr lange Nachbeobachtungszeit über das Verfallsdatum der jeweilig untersuchten HS-Spritzen hinaus. Berücksichtigt man jedoch die Tatsache, dass die meisten Reinjektionen mit Hyaluronsäure im Rahmen eines Touch-up innerhalb von einigen Wochen erfolgen, so liegen in der Veröffentlichung diesbezüglich leider keine Daten vor. Wünschenswert wäre gewesen, entsprechende kulturelle Untersuchungen bereits nach 2 Wochen und beispielsweise nach 16 Wochen zu integrieren, um zusätzliche Informationen zum zeitlichen Beginn einer möglichen Kontamination zu erhalten. Diese Aussage hätte sicherlich eine sinnvolle klinische Relevanz gehabt. Schlussfolgernd kann man anhand der Untersuchungen von Al-Haddab et al. festhalten, dass bei der Lagerung von angebrochenen HS-Fillern Vorsicht zu walten ist, da eine Sterilität nach Anbruch nicht gewährleistet werden kann. In jeder Behandlungssitzung sollte das Material aufgebraucht bzw. die Restmenge unabhängig etwaiger kommerzieller Interessen verworfen werden.
Literatur
- Bellew SG, Carroll KC, Weiss MA, Weiss RA. Sterility of stored nonanimal, stabilized hyaluronic acid gel syringes after patient injection. J Am Acad Dermatol 2005;52:988–90.
- Goulart JM. Groysman T. LaBombardi V. Comite S, et al. Sterility of injectable fillers containing nonanimal stabilized hyaluronic acid, hyaluronic Acid, or calcium hydroxylapatite after long-term storage. Cosmet Dermatol 2010;23:400–2.
- Bhatia AC, Arndt KA, Dover JS, Kaminer M, et al. Bacterial sterility of stored nonanimal stabilized hyaluronic acid-based cutaneous filler. Arch Dermatol 2005;141:1317–8.
- Safo PK, Wahlgren C, Obagi S. Safety of storing and reusing hyaluronic acid fillers: a retrospective chart review. Cosmet Dermatol 2011;24:22–6.
Verfasser
Dr. med. Matthias Imhof
Hautmedizin Bad Soden
Ästhetische Dermatologie im Medico Palais
Parkstrasse 6
65812 Bad Soden
www.hautmedizin-badsoden.de
News DGDC
Neue Webinartermine für 2026
Es geht weiter! Unsere neuen Webinar-Termine stehen fest – mit frischem Input, aktuellen Themen und Raum für Ihre Fragen. Gleich anmelden!
Neue Ausschreibung für Hospitationsstipendien
Die Deutsche Gesellschaft für Dermatochirurgie (DGDC) schreibt insgesamt fünf Stipendien zur Unterstützung von Hospitationen in zertifizierten Dermatochirurgischen Zentren in Deutschland, Österreich und Italien aus.
Webinar verschoben
Unser letztes DGDC-Webinar dieses Jahr zum Thema: Histopathologie und Dermatochirurgie: Tipps und Fallstricke wurde verschoben!